逐步展开世界上最小的生物旋转电机
三磷酸腺苷 (ATP) 是细胞的能量货币。它为各种需要能量的细胞过程提供动力,包括酶促反应。ATP 是在称为 F 型 ATP 合酶的酶复合物的帮助下合成的。这种酶复合物具有双向功能,可根据环境和细胞信号合成 ATP 并水解它。ATP 合酶由两个旋转马达组成——F 1和 F 0。F 1亚复合体主要由α、β和γ亚基组成。在ATP水解过程中,F 1 -ATP酶呈旋转运动。因此,F 1-ATPase也被称为世界上最小的旋转生物分子马达。然而,ATP 水解如何使分子旋转的潜在机制仍不清楚。
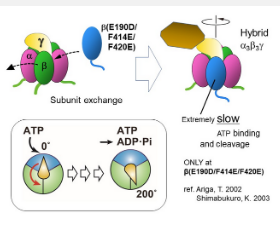
为了解决这一知识差距,由东京理科大学副教授 Tomoko Masaike 领导的日本研究小组着手研究嗜热细菌Bacillus PS3中 F 1 -ATPase 旋转机制背后的事件。Masaike 博士在阐述他们的研究目标时解释说:“我们想阐明 F 1 -ATPase 在 ATP 水解过程中旋转中心轴的机制。我们专注于阐明底物 ATP 与酶的结合与其高能磷酸键的裂解之间中心轴的旋转角度。” 这项研究是与学习院大学的 Takayuki Nishizaka 教授和 Hamamatsu Photonics KK 的 Yuh Hasimoto 合作进行的,该研究于 2022 年 12 月 21 日和 2023 年 2 月 7 日在线发表在《生物物理学杂志》上。
先前对芽孢杆菌PS3的 F 1亚基的研究已经确定 ATP 裂解涉及化学机械偶联,即每个旋转步进运动都与化学反应步骤相关联。ATP 结合及其在同一催化位点的裂解之间的旋转角度先前估计为 200°。然而,迄今为止还缺乏证实这一点的实验证据。为了解决这个问题,研究人员通过使用一个突变体 β 和两个野生型 β 创建一个杂交 F 1来研究旋转。由于突变体中 ATP 裂解和 ATP 结合的速率都非常慢,研究人员可以很容易地观察到旋转步骤之间的暂停或停留。
在用不同浓度的 ATP 进行单分子旋转测定时,他们可以观察到三组短驻留和长驻留交替关联,每次旋转的间隔为 80° 和 40°。为了调查与停留相关的事件,作者进行了停留时间分析。40° 子步骤之前的长时间停顿与 ATP 浓度无关,并被确认为“催化停留”——由于 ATP 裂解导致轴旋转的停顿。或者,在 80° 步骤之前的短暂停顿显然取决于 ATP 浓度,因此被确定为“ATP 等待停留”(暂停以使 β 亚基能够结合 ATP)。“在研究轴的旋转后,我们可以通过光学显微镜提供可见的证据,证明轴在 ATP 结合和切割事件中的角度Bacillus PS3 分别为 0 °和 200 ° ,” Hasimoto 说。
通过这项研究,作者解决了关于 ATP 裂解轴角的长期争论,并建立了 ATP 酶功能的化学机械相关性。谈及这项新研究的未来影响,Masaike 副教授阐述道:“由于 F 1 -ATPase 是世界上最小的生物旋转运动蛋白,它可以作为了解生物体内能量转导机制的参考。” 这些知识对于开发高效的纳米机器具有革命性意义。此外,来自结核分枝 杆菌的ATP 合酶最近已被确定为药物发现的潜在目标。因此,要使用抑制剂阻止其旋转,了解旋转机制非常重要。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
作为全部11支MotoGP车队及90% Moto2和Moto3车队的供应商,布雷博如今已成为顶级摩托车赛事的技术标杆。全球制...浏览全文>>
-
(2025 年 6 月 14 日,广州)6 月 14 日晚,华语摇滚乐坛标志性人物苏见信(信)携「尽兴而活」巡回...浏览全文>>
-
(2025 年 6 月 14 日,广州)6 月 14 日晚,华语摇滚乐坛标志性人物苏见信(信)携「尽兴而活」巡回...浏览全文>>
-
淮北威然是一款备受关注的商务MPV车型,以其宽敞的空间、豪华的内饰和卓越的舒适性吸引了众多消费者的目光。对...浏览全文>>
-
途观X作为上汽大众旗下的高端轿跑SUV,凭借其独特的设计和强劲的性能吸引了众多消费者的关注。在淮南地区,途...浏览全文>>
-
探岳X作为一款备受关注的中型SUV,凭借其时尚的设计和出色的性能,在市场上一直拥有不错的口碑。对于有意购买...浏览全文>>
-
2025款大众高尔夫GTI作为一款备受关注的高性能紧凑型轿车,在汽车市场中一直占据着重要地位。对于安徽亳州地区...浏览全文>>
-
池州长安启源C798作为一款备受关注的新能源车型,在市场上一直保持着较高的热度。随着消费者对新能源汽车需求...浏览全文>>
-
安徽池州地区的汽车市场近期迎来了一波喜讯,2025款高尔夫GTI的新车报价再次刷新了消费者的期待。这款备受瞩目...浏览全文>>
-
济南揽境作为一款备受关注的中大型SUV,其2025新款在外观设计、内饰配置以及动力性能方面均进行了全面升级。新...浏览全文>>
- 三星获得基于一天中的时间和天气的人工智能壁纸功能专利
- 如何将陶瓷融入室内设计
- 努萨海滨豪宅标价 2000 万美元
- 三星 Galaxy S25 Slim:泄露 iPhone 17 Air 竞争对手的旗舰相机规格
- AMD Radeon RX 8800 XT 参考设计在意外广告中泄露
- M3 Touring 与 RS4 Avant:终极冬季测试
- 量产版 Corvette 仅用了令人震惊的 2.3 秒就从 0 加速到 60 英里/小时
- 婴儿潮一代希望房价上涨
- 购买 OnePlus 12 可节省 250 美元
- 更新后的奥迪 E-tron GT:性能和价格均有所提高
- 达尔文市场将在 2025 年回暖
- Circle to Search 可能看起来更像 Apple Intelligence
- 2023年财富全球论坛荣耀对可折叠智能手机等的预测
- TECNO Spark Go 2024配备6.6英寸90Hz显示屏立体声扬声器在发布前预告
- 橡树城改造扩大到包括豪华生活的定制住宅
- Netflix将哈迪斯时空幻境和死亡之门添加到其游戏库中
- 联想Legion Go发布时间表已公布并列在该公司的官方网站上
- 苹果手表最佳优惠
- Stardock发布Fences5预览版现已适用于Windows11和10
- 揭晓Scout重新定义冒险骑行的终极步进电动自行车
